Estudio demuestra el potencial de una plataforma de nanopartículas para administrar dsARN antivirales a animales acuáticos

El Virus del Síndrome de Mancha Blanca (WSSV, por sus siglas en inglés) es el patógeno del camarón de mayor importancia económica y mundial, y destruye una décima parte de la producción de camarón de cultivo (alrededor de US$ mil millones de dólares) cada año. Los camarones infectados con WSSV sucumben al patógeno dentro de dos a siete días, con una mortalidad de hasta el 100 por ciento. Es importante desarrollar enfoques de intervención de enfermedades que sean seguros y eficaces y, en este sentido, las estrategias de vacunación como virus inactivados, subunidades de antígenos y vacunas basadas en ADN contra WSSV se han mostrado prometedoras a escala de laboratorio. Sin embargo, los inconvenientes ̶ como la eficacia variable, el alto costo de fabricación y la aplicabilidad de campo limitada ̶ justifican una mayor investigación.
El ARN de interferencia (ARNi) en invertebrados es un mecanismo celular antiviral por el cual un activador, como el ARN de doble cadena (dsARN) o el ARN pequeño de interferencia (siARN), impide la expresión de genes virales. Estos dsARN se han probado en una amplia variedad de entornos, como en el control de plagas de plantas, mosquitocidas de próxima generación y diseño de vacunas. En los sistemas acuícolas, el concepto de vacunas basadas en ARNi ha sido defendido por varias razones: (a) ARNi funciona como una respuesta inmune antiviral en camarones; (b) es patógeno-específico; y (c) genera una respuesta inmune protectora a largo plazo.
Investigación previa ha demostrado que las vacunas basadas en dsARN no son tóxicas, son eficaces y brindan protección contra una dosis letal de WSSV. Sin embargo, en todas las aplicaciones mencionadas anteriormente, el principal desafío para la progresión de una vacuna basada en dsARN desde el descubrimiento hasta el producto y la aplicación de campo es su estabilidad ambiental y los costos de fabricación. Nuestra hipótesis es que las limitaciones para la entrega de dsARN en el campo podrían superarse utilizando una plataforma de entrega de nanoportadores que mejora aún más la absorción celular, establece largos tiempos de residencia en los tejidos, ahorra dosis, lo que reduce el costo y es adaptable para vacunas masivas. En este sentido, las nanopartículas de polianhídrido biodegradables han demostrado ser sistemas de administración eficaces para vacunas y fármacos basados en antígenos.
Este artículo – adaptado y resumido de la publicación original (Phanse, Y. et al. 2022. RNA Nanovaccine Protects against White Spot Syndrome Virus in Shrimp. Vaccines 2022, 10(9), 1428) – discute los resultados de una prueba de estudio conceptual, el primero según el conocimiento de los autores y que combina dos tecnologías de plataforma (dsARN específico de virus basado en ARNi y una plataforma de entrega basada en nanopartículas de polianhídrido) para desarrollar una nanovacuna para aplicaciones acuícolas.
Configuración del estudio
Se adquirieron L. vannamei libres de patógenos específicos (SPF) de Shrimp Improvement Systems (Islamorada, FL EE. UU.). Los animales se aclimataron durante una o dos semanas en tanques de fibra de vidrio aireados de 1 tonelada llenos de agua de mar artificial (salinidad 28–30 ppt). La temperatura del agua se mantuvo entre 25 y 27 grados-C. Los animales fueron alimentados dos veces al día con Raceway más alimento comercial para camarones de acuerdo con el tamaño y la etapa de desarrollo (Zeigler Bros, Gardners, PA EE. UU.).
El efecto de la química de las nanopartículas sobre la seguridad, la biodistribución y la persistencia se evaluó in vivo en los camarones. Para imitar una vía de administración oral, las nanovacunas se inyectaron por sonda inversa para apuntar al epitelio gastrointestinal, y la eficacia de la nanovacuna se probó en un modelo de desafío letal WSSV in vivo en camarones.
Para obtener información detallada sobre el diseño experimental; síntesis de dsARN; síntesis de polianhídridos y nanopartículas; histopatología, biodistribución y otros componentes del estudio; y análisis estadísticos, consulte la publicación original.
Resultados y discusión
Aunque la nanomedicina ya ha hecho contribuciones notables a la salud humana, su uso en la promoción de la salud animal aún está en pañales. Numerosos estudios han demostrado que las nanopartículas de polianhídrido son excelentes vehículos para la administración de antígenos al proporcionar estabilidad antigénica, liberación controlada, soporte intrínseco e inmunidad protectora. Sin embargo, este es el primer estudio que conocemos que demuestra su uso como vehículos de administración de dsARN para estrategias de vacunación profiláctica en invertebrados.
Se demostró que las nanopartículas de polianhídrido son adecuadas para la encapsulación y liberación de dsARN. Si bien las dos nanoformulaciones que probamos proporcionaron una cinética de liberación de dsARN de orden casi cero, la eficiencia de encapsulación de dsARN fue mucho mayor en una, denominada nanopartículas 20:80 CPTEG:CPH.
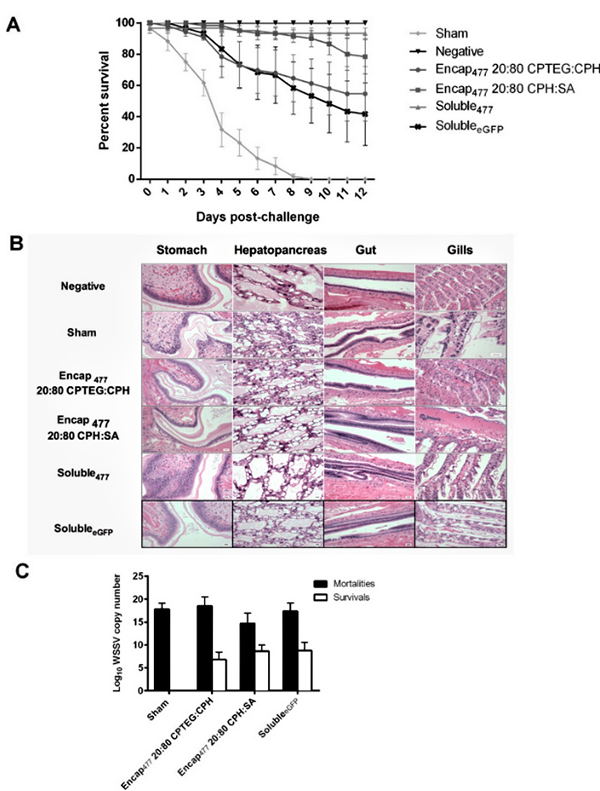
Una de las principales preocupaciones de las vacunas para animales de alimentación es que no deben causar ningún efecto adverso en el rendimiento final. Nuestros datos demuestran que ninguna de las dos nanoformulaciones probadas indujo ningún efecto adverso en los camarones inyectados por sonda inversa, incluso con una dosis de nanopartículas cinco veces mayor que la requerida para la administración de la vacuna. El análisis histopatológico ciego confirmó que no se produjeron anomalías histológicas en el tejido del tracto alimentario o las branquias de los camarones debido a las nanopartículas. Y también se evaluó un marcador de inflamación en camarones y se encontró que no era diferente al de los animales de control. Finalmente, la ganancia de peso del camarón, que es el contribuyente más importante al rendimiento de la granja, mostró que las partículas no afectaron el desarrollo normal del camarón. Estos resultados están de acuerdo con trabajos previos que demuestran la seguridad de las nanopartículas de polianhídrido.
También probamos si la química de las nanopartículas afecta la biodistribución tisular y la persistencia en L. vannamei. Como era de esperar, las nanopartículas estaban presentes en el intestino, sin duda facilitadas por la vía de administración; sin embargo, a las dos horas también se visualizaron en estómago, hepatopáncreas y cefalotórax. Curiosamente, en el día 0, los tejidos branquiales mostraron niveles muy altos de nanopartículas. Si bien nuestro trabajo anterior ha demostrado que las partículas migran sistémicamente en otros modelos animales, aún no se han determinado los mecanismos por los cuales las nanopartículas se transportan a las branquias. Es importante tener en cuenta que las branquias son uno de los órganos diana de varios patógenos virales, como el Virus del Síndrome de Taura, el Virus de Cabeza Amarilla y el WSSV. Así, la presencia de nanopartículas en branquias contribuye potencialmente a la protección frente a enfermedades provocadas por estos virus.
La persistencia de nanopartículas es otro resultado importante para permitir que los animales vacunados estén protegidos de la enfermedad a lo largo de diferentes etapas de la vida (poslarva, juvenil o adulto). Nuestro trabajo anterior ha demostrado que algunas propiedades de los polímeros pueden afectar significativamente el tiempo de residencia de las nanopartículas en los tejidos de los ratones. Nuestras dos nanopartículas, CPH:SA y CPTEG:CPH, persistieron en el tejido del tracto alimentario y las branquias de los camarones durante al menos 21 días después de la inyección. La combinación de una larga persistencia de partículas junto con una corta vida útil de los camarones puede compensar la falta de memoria inmunológica adaptativa y brindar protección durante la fase de engorde de la cría de camarones.
Las vacunas basadas en dsARN se pueden usar de manera efectiva contra varios virus de camarones; sin embargo, el desarrollo de estrategias de entrega adecuadas para la vacunación masiva de camarones en sistemas acuáticos es un gran desafío. La administración oral a los camarones (es decir, a través del alimento) es, con mucho, el método más atractivo de administración de vacunas. Nuestros experimentos demostraron que nuestra nanovacuna, cuando se administra directamente en el intestino, brinda una protección significativa contra una dosis letal de WSSV. Se utilizó una estrategia de administración por sonda inversa para imitar la administración oral y los resultados indicaron que las nanovacunas protegían el dsARN encapsulado del entorno intestinal y administraban un activador de ARNi de WSSV estable y funcional. Las nanovacunas no solo aumentaron la capacidad de supervivencia de los camarones desafiados, sino que también redujeron la replicación del WSSV in vivo.
Este hallazgo puede tener implicaciones importantes en el campo, ya que se sabe que la transmisión horizontal de WSSV en un estanque de camarones puede ser por contacto directo con cadáveres infectados, es decir, por canibalismo o por vía indirecta a través del agua. Independientemente de la ruta de transmisión, la carga viral reducida puede contribuir a disminuir la propagación del WSSV en condiciones de campo al reducir la dosis viral disponible.
Aunque una de nuestras nanovacunas proporcionó mayor protección contra la infección en este trabajo que la otra, es importante comprender la ventaja de cada nanoformulación. Por ejemplo, una de las nanovacunas resultó en una gran explosión inicial, de modo que casi el 90 por ciento del dsARN encapsulado se liberó rápidamente. Debido a esta gran explosión, es probable que haya grandes cantidades de dsARN disponibles en el tracto alimentario de los camarones en el momento de la infección (72 horas después de la vacunación) y una mayor protección. Por el contrario, la explosión inicial de dsARN de la otra nanovacuna fue menor. En general, es concebible que la administración de un cóctel de ambas nanovacunas permita una inmunidad temprana y duradera en los camarones.
Perspectivas
En conjunto, los datos de nuestro estudio demuestran la capacidad de la plataforma de administración de nanopartículas de polianhídrido para administrar antivirales dsARN a los animales acuáticos. WSSV, siendo el más amenazante de los virus del camarón, se utilizó en este estudio; sin embargo, la rápida adaptación de dsARN contra otros virus puede hacer que esto también se adapte a otras enfermedades.
Además, la versatilidad que ofrece esta tecnología para entregar una amplia gama de moléculas antibióticas, antivirales y antifúngicas tiene el potencial de mejorar la acuacultura global mediante el control de enfermedades. El resultado final es un producto novedoso que, en última instancia, proporciona terapias más efectivas y de dosis más bajas para beneficiar la salud animal, con un tremendo potencial para contribuir así a mejorar la seguridad alimentaria y la salud ambiental.
Ahora que Ud. ha terminado de leer este artículo...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria acuícola mundial y compartir el conocimiento expansivo de nuestra amplia red de colaboradores cada semana.
Al convertirse en miembro de la Global Seafood Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de beneficios, recursos y eventos para miembros pueda continuar. La membresía individual cuesta solo $50 al año.
¿No es miembro de la GSA? Únase a nosotros.
Author
-
Lyric C. Bartholomay, Ph.D.
Corresponding author
Department of Entomology, Iowa State University, Ames, IA 50011, USA; and
Department of Pathobiological Sciences, University of Wisconsin-Madison, Madison, WI 53706 USA[117,100,101,46,99,115,105,119,64,121,97,109,111,108,111,104,116,114,97,98,108]
Tagged With
Related Posts

Intelligence
Acuacultura 2019: La reunión trienal examina el estado global de la industria
La reunión trienal de Acuacultura 2019, que también celebró el 50 aniversario de la Sociedad Mundial de Acuacultura, presentó a todos los segmentos de la cadena de valor de la acuacultura durante 104 sesiones técnicas.

Health & Welfare
Bacterioma intestinal de camarones blancos del Pacífico en sistemas de biofloc y de agua clara
Descripción global del bacterioma intestinal del camarón blanco del Pacífico en sistemas de biofloc y de agua clara, y después de un desafío oral por el virus del síndrome de la mancha blanca.

Intelligence
Estrategia de mercadeo unificada para camarones avanza despacio
El Foro del Camarón regresó al SENA con información sobre las innovaciones en la producción, la amenaza de la resistencia antimicrobiana, un enfoque de mercadeo unificado y un pronóstico de la India.

Health & Welfare
Opinión: la OIE, la Organización Mundial de Sanidad Animal, necesita el aporte de la industria pesquera
El autor argumenta que la OIE debería considerar todos los productos de pescado y camarón como seguros para el comercio, independientemente del estado patógeno del país exportador.



