Estudio concluye que las líneas de P. vannamei cultivadas actualmente en Ecuador son tolerantes a los genotipos de IHHNV circulantes

El Virus de la Necrosis Hipodérmica y Hematopoyética Infecciosa (IHHNV) ha sido catalogado como un patógeno de crustáceos de notificación obligatoria por la Organización Mundial de Sanidad Animal (OIE) desde 1995 y tiene una alta prevalencia en América, Asia y Australia. Anteriormente, el virus causó mortalidades a gran escala en el camarón azul del Pacífico (Penaeus stylirostris) y causa un retraso en el crecimiento llamado Síndrome de Deformidad Enana (RDS), en el camarón blanco del Pacífico (Penaeus vannamei) y el camarón tigre negro (Penaeus monodon). Actualmente, se ha documentado la presencia de cinco genotipos (tres tipos infecciosos: I, II y III, y dos tipos no infecciosos: A y B de IHHNV.
El IHHNV es un patógeno endémico en la mayoría de los países de América Latina, incluidos Ecuador, México, Honduras, Colombia, Brasil y Perú. Se ha reportado infección por IHHNV en varias etapas de vida de P. vannamei, incluidas las postlarvas, los juveniles y los reproductores, sin ningún signo clínico, incluido el RDS. A nivel de granja, la prevalencia del virus puede oscilar entre el 10 y el 50 por ciento, y los animales pueden parecer saludables. Sin embargo, aún se desconoce si la presencia del virus hace que los camarones sean más susceptibles a otros patógenos, y si los animales infectados crónicamente tienen un impacto en el crecimiento y la productividad de la granja.
Las actualizaciones sobre el impacto actual del IHHNV en las industrias camaroneras Ecuatoriana y Peruana son insuficientes para determinar el impacto del patógeno a nivel de granja. Sin embargo, según la OIE, entre 2012 y 2019 se han notificado un total de 25 y 21 casos de IHHNV en estanques de engorde en Ecuador y Perú, respectivamente.
Este artículo – adaptado y resumido de la publicación original [Aranguren Caro, L.F. et al. 2022. Current status of infection with infectious hypodermal and hematopoietic necrosis virus (IHHNV) in the Peruvian and Ecuadorian shrimp industry. PLoS ONE 17(8): e0272456] –reporta sobre un estudio para determinar la influencia de las cepas infecciosas circulantes de IHHNV presentes en Perú y Ecuador en la producción de camarones en estos dos países utilizando tres enfoques diferentes. Estos incluyen 1) determinar la prevalencia de IHHNV y evaluar el efecto de IHHNV en el crecimiento del camarón en estanques comerciales de crecimiento; 2) determinar la secuencia completa del genoma de los genotipos de IHHNV en Ecuador y Perú y examinar su relación con otros aislamientos de IHHNV notificados en otras partes del mundo; y 3) evaluar la infectividad de los aislamientos de IHHNV en Perú y Ecuador en tres especies diferentes de peneidos: P. vannamei, P. monodon y P. stylirostris.
Configuración del estudio
Los aislamientos de IHHNV se recolectaron en Tumbes y Piura, al norte de Perú, y en tres regiones de Ecuador, a saber, El Oro, Guayaquil y Esmeraldas. El muestreo fue realizado por el Organismo Nacional de Sanidad Pesquera del Perú (SANIPES) y la Cámara Nacional de Acuacultura del Ecuador.
Se recolectaron seis aislamientos de IHHNV de Perú entre 2019 y 2020 de las regiones de cultivo de camarón en Tumbes y Piura. En Ecuador, en 2020 se seleccionaron estanques de engorde que mostraban un alto coeficiente de variación (CV > 20por ciento) con antecedentes de ocurrencia de IHHNV. Se analizaron ocho estanques de engorde distribuidos en Guayas, El Oro y Esmeraldas. De cada estanque de engorde, se tomaron muestras aleatorias de 30 camarones, se pesaron y se conservaron sus pleópodos y tejidos branquiales para el análisis de PCR en tiempo real. Los camarones adicionales recolectados de cada uno de estos lugares se congelaron individualmente (-20 grados-C) para su posterior análisis. Finalmente, del mismo estanque, se fijaron de 5 a 10 camarones en fijador de Davidson para análisis histológico. Se enviaron muestras de Perú y Ecuador al Laboratorio de Patología Acuícola de la Universidad de Arizona (UA-APL) para su posterior análisis.
Para obtener información detallada sobre la detección del IHHNV y la secuenciación del genoma; análisis filogenéticos; la prueba de desafío del IHHNV; histopatología e hibridación in situ; y análisis estadísticos, consulte la publicación original.
Resultados y discusión
Aquí presentamos datos sobre la prevalencia de IHHNV y su impacto en el crecimiento de P. vannamei en estanques de engorde en tres importantes regiones productoras de camarón en Ecuador. También determinamos la secuencia del genoma del virus en P. vannamei originario de Ecuador y su país vecino, Perú, donde prevalece el IHHNV. Finalmente, realizamos un bioensayo experimental utilizando aislamientos de IHHNV originarios de Ecuador y Perú para determinar la virulencia del virus en tres especies de camarones peneidos SPF: P. vannamei, P. monodon y P. stylirostris.
Análisis de granja
Muestras de P. vannamei de estanques de engorde que representan tres regiones diferentes en Ecuador fueron examinadas para IHHNV. El virus estaba presente en muestras recolectadas de los ocho estanques de engorde ubicados en las tres regiones diferentes, y la prevalencia de IHHNV varió ampliamente de 3.3 a 100 por ciento. En el análisis de PCR en tiempo real, algunos camarones mostraron resultados negativos, mientras que otros mostraron un número de copias de hasta 2,9 × 105 copias/ng de ADN.
Para establecer la asociación entre el peso de los camarones y la presencia de IHHNV, la población de cada estanque se dividió en dos grupos según los resultados de la PCR en tiempo real (IHHNV positivo y IHHNV no detectado). Como se muestra en la Fig. 1, no hubo correlaciones significativas entre el peso promedio de los camarones y la presencia de IHHNV dentro del mismo estanque.
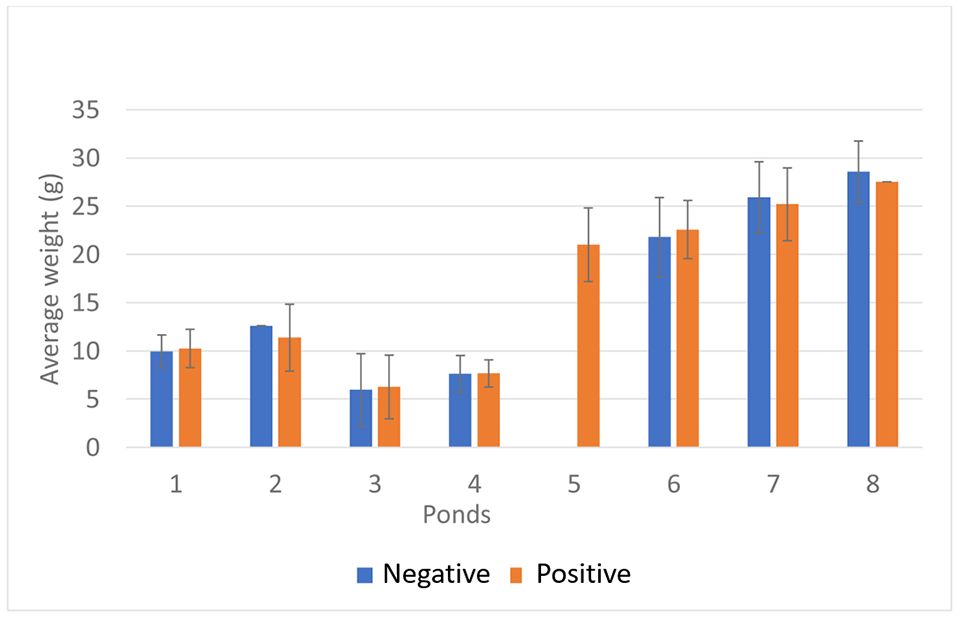
Sellars, et al. demostraron que en una granja de P. monodon en Australia, el rendimiento del crecimiento y la supervivencia se redujeron en estanques de crecimiento con un alto número de copias de IHHNV (0,5 × 103 a 2,24 × 106 copias/ng de ADN). En nuestro estudio, el número medio de copias de IHHNV varió entre 5,9 × 100 y 1,4 × 104 copias/ng de ADN, que es menor que la carga de IHHNV reportada por Sellars et al., lo que puede explicar parcialmente la poca o ninguna influencia en el rendimiento del crecimiento. Hubo una correlación directa significativa entre el número de copias de IHHNV y la prevalencia de IHHNV en los estanques de crecimiento. La prevalencia y el número de copias fue alto. Resultados similares en estanques de crecimiento fueron reportados por Sellars et al. Estos hallazgos son consistentes con el patrón de infección con agentes infecciosos.
Para comprender mejor el efecto de la carga de IHHNV en el crecimiento de los camarones P. vannamei en un estanque determinado, las poblaciones de camarones se dividieron en tres categorías según el número de copias de IHHNV: no detectado, bajo a medio, y alto. Solo tres de los ocho estanques de crecimiento (estanques 2, 3 y 7) tenían camarones representativos de las tres categorías. Como se muestra en la Fig. 2, hubo una tendencia inversa entre el número de copias de IHHNV y el peso de los camarones, con animales que tenían cargas virales más altas y pesos más bajos. En un caso (estanque 2), se observó una correlación significativa. Estos estanques de engorde tenían el número medio de copias más alto de IHHNV. Un estanque de engorde (estanque 5) que también mostró un alto número medio de copias de IHHNV no se analizó debido al hecho de que el 100 por ciento de los camarones dieron positivo para IHHNV. Vale la pena señalar que no se observó RDS en los camarones recolectados de ninguno de los tres estanques o los cinco estanques restantes.
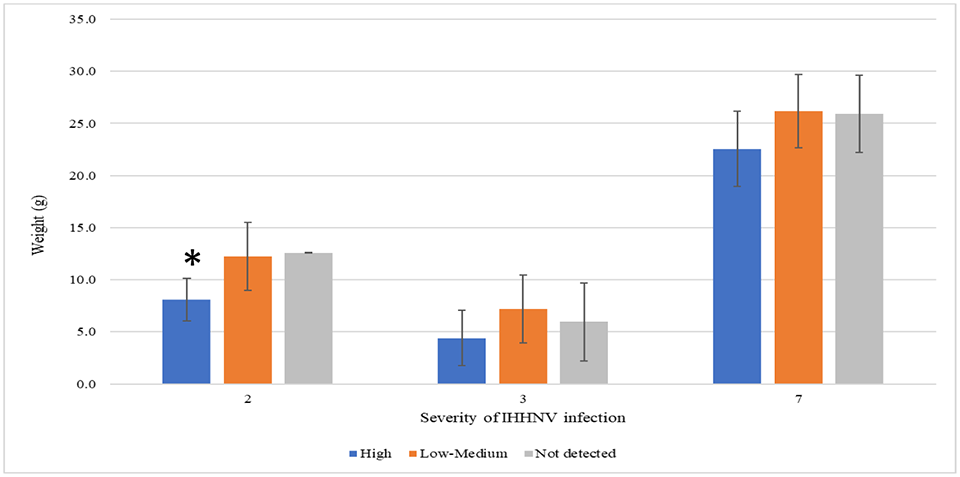
Históricamente se reportó que el IHHNV causaba SDR en P. vannamei, lo que generaba grandes disparidades de tamaño y deformidades en el crecimiento. Un informe reciente de la India documentó deformidades, incluido el sexto segmento abdominal deformado, rostrum deformes, aspereza cuticular y antenas arrugadas, y una amplia variación en el tamaño de los estanques de engorde de P. vannamei analizados de 350 granjas de camarón. En ese estudio, desafortunadamente, solo se analizaron camarones con signos clínicos; por lo tanto, no fue posible determinar la prevalencia de IHHNV en individuos sanos de los mismos estanques. Un estudio anterior de la India reportó la presencia de dos patógenos, el virus del síndrome de la mancha blanca (WSSV) y el IHHNV, sin deformidades externas. Desde esta perspectiva, nuestros hallazgos sugieren un primer vistazo único de la capacidad inherente de ciertas líneas genéticas de P. vannamei para llevar una carga viral alta sin mostrar signos clínicos.
Secuencia del genoma de IHHNV y análisis filogenéticos
En nuestro estudio, se utilizó la secuencia completa del genoma del VNHHI (AF218266) como referencia para el mapeo. El genoma de IHHNV varía en longitud; por ejemplo, el IHHNV aislado de Brasil tiene una longitud de 3739 nt [un nucleótido, abreviado nt, es una unidad de longitud común para los ácidos nucleicos monocatenarios], y el IHHNV aislado de la India tiene una longitud de 3908 nt. En nuestro estudio, el genoma de IHHNV tenía un tamaño promedio de 3957 nt, que estaba en el rango del tamaño genómico de IHHNV. Además, a través de varios análisis, demostramos la singularidad de las nuevas secuencias de IHHNV encontradas en América Latina.
El árbol filogenético [diagrama que muestra las relaciones evolutivas entre varias especies biológicas] que construimos a partir de la secuencia completa del genoma de IHHNV reveló que todos los aislamientos de IHHNV de Perú y Ecuador pertenecían al mismo grupo de IHHNV clado tipo 2 que los aislamientos de IHHNV del este de Asia y las Américas, como se describe en otra parte. Sin embargo, parece que forman un nuevo subclado [un clado es un grupo de organismos compuesto por un ancestro común y todos sus descendientes lineales] dentro de esta cepa tipo 2. Por lo tanto, proponemos un nuevo tipo de IHHNV aislado de estas dos regiones geográficas. Una posible explicación es el frecuente movimiento de postlarvas de Ecuador a Perú. Durante la vigilancia activa realizada por SANIPES, se analizaron por PCR muestras de postlarvas importadas de lotes ecuatorianos. La frecuencia de IHHNV en estas muestras fue del 55 por ciento (15 de 27 muestras) en 2019, del 52 por ciento (75 de 144 muestras) en 2020 y del 76,3 por ciento (55 de 72 muestras) en 2021.
Virulencia de aislamientos de IHHNV de Ecuador y Perú determinada por desafío experimental
Para el desafío experimental, se utilizaron aislamientos de IHHNV de Ecuador y Perú para infectar experimentalmente camarones SPF. La virulencia de los aislamientos de IHHNV se determinó en base a la tasa de supervivencia final, RDS, número de copias de IHHNV, lesiones histológicas e hibridación in situ (ISH). Aunque se utilizó SPF P. vannamei para los bioensayos de IHHNV para los aislamientos de Ecuador y Perú, también se analizaron dos especies adicionales, P. monodon y P. stylirostris, para el bioensayo de IHHNV-Ecuador. En general, la supervivencia fue muy alta en las tres especies (97-100 por ciento de supervivencia), incluso cuando el inóculo se administró mediante inyección con un alto número de copias virales (9,0 × 106 copias). Estos resultados respaldan claramente la idea de que estas líneas SPF son tolerantes a los aislamientos de IHHNV utilizados en el bioensayo.
A pesar de la falta de mortalidad en el bioensayo, los camarones inyectados con IHHNV tenían una alta carga de IHHNV al final del experimento. Las cepas de IHHNV de Perú y Ecuador no causaron mortalidad en dos especies de camarón endémicas (P. vannamei y P. stylirostris) y una especie de camarón exótica (P. monodon). Estos hallazgos pueden explicarse en parte considerando los antecedentes históricos de la población de P. stylirostris. La línea genética de P. stylirostris utilizada en este estudio se originó en México y es probable que sea un progenitor de una población resistente al IHHNV que se seleccionó de sobrevivientes de un brote de IHHNV.
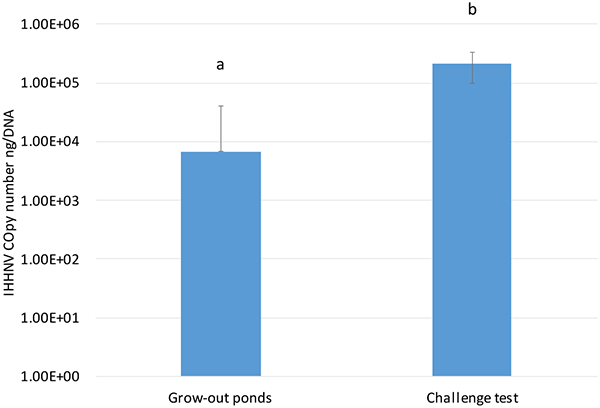
Cuando se comparó la carga de IHHNV en P. vannamei criado en estanques de crecimiento en Ecuador con la carga de IHHNV encontrada en el SPF P. vannamei utilizado en el desafío experimental, hubo una diferencia significativa en las cargas virales (P<0.001), con un mayor número de copias de IHHNV en la población SPF utilizada para la prueba de desafío que en P. vannamei criado en granja (Fig. 3). Aunque se desconocen los antecedentes genéticos de la línea SPF utilizada en el bioensayo y el P. vannamei criado en granja, los datos sugieren una alta tolerancia de las poblaciones endémicas de camarón que se están criando en la industria camaronera ecuatoriana. Actualmente, en América Latina, la mayoría de los camarones se han criado en condiciones en las que el IHHNV es endémico, y el uso de reproductores criados en estanques aparentemente ha adquirido una selección no intencional para la resistencia a enfermedades, incluido el IHHNV. Esta tolerancia/resistencia puede explicar la ausencia de RDS asociado con la infección por IHHNV en estanques comerciales de engorde que crían P. vannamei.
En la industria de cultivo de camarones de América Latina, el IHHNV ha sido uno de los patógenos más prevalentes reportados en los últimos 20 años por el Sistema Mundial de Información sobre Sanidad Animal (WAHIS). La acomodación viral es una hipótesis propuesta a principios de 2009 y luego actualizada en 2019. Está relacionada con una infección persistente tolerada en la que los virus o fragmentos de su genoma se insertan en el genoma del camarón mediante un mecanismo de huésped independiente que podría tener un efecto protector, lo que podría explicar la ausencia de signos clínicos. Además, Taengchaiyaphum, et al. confirmaron recientemente una reducción significativa en el número de copias de IHHNV en P. vannamei donde estaba presente una copia viral circular de IHHNV (cvcDNA). Este fenómeno podría explicar la ausencia de RDS y lesiones histológicas severas en camarones infectados con IHHNV en América Latina.
Conclusiones
El IHHNV es un patógeno con alta prevalencia en granjas camaroneras en América Latina. Encuestamos la prevalencia de IHHNV en estanques comerciales de engorde en tres importantes regiones productoras de camarón de Ecuador y evaluamos su impacto en el crecimiento del camarón. Al confirmar la presencia del virus en estanques comerciales en Ecuador, determinamos la secuencia del genoma del virus en su rango endémico de Ecuador y Perú. Finalmente, mediante un bioensayo experimental, determinamos la virulencia de los aislamientos de IHHNV-Ecuador y IHHNV-Perú utilizando tres especies diferentes de camarones peneidos: P. vannamei, P. monodon y P. stylirostris. Nuestros datos revelaron que IHHNV no causó mortalidad en las especies desafiadas y no tuvo un impacto notable en la producción de camarones.
Una amplia variación en la prevalencia de IHHNV probablemente se deba a muchos factores, como los días de cultivo cuando se recolectaron las muestras, el estado de salud de las postlarvas utilizadas para sembrar los estanques, los antecedentes genéticos de las postlarvas, las condiciones de cultivo, el manejo de la granja y otros factores desconocidos. Dejando a un lado los datos de prevalencia porcentual, en estanques con animales que no portaban IHHNV a niveles altos, encontramos una tendencia negativa entre la carga de IHHNV y el peso del camarón en el estanque correspondiente. Los datos de secuenciación de próxima generación (NGS) revelaron que los genotipos de IHHNV que circulan en Ecuador y Perú representan la forma infecciosa de IHHNV.
Finalmente, en bioensayos de laboratorio que duraron 30 días utilizando aislamientos de IHHNV de Ecuador y Perú, no pudimos reproducir ninguna manifestación clínica de infección por IHHNV en P. vannamei ni ninguna mortalidad significativa en ninguna de las tres especies de camarones peneidos. Además, aunque se detectó IHHNV en las tres especies mediante PCR en tiempo real, la carga viral fue significativamente mayor en P. vannamei que en P. monodon y P. stylirostris. Además, mediante el análisis histológico de H&E, se detectaron cuerpos de inclusión tipo A de Cowdry, que se consideran característicos de una enfermedad en particular, de la infección por el IHHNV en P. vannamei y P. monodon, pero no en P. stylirostris. Se realizó hibridación in situ (ISH) para delinear las lesiones específicas de IHHNV en P. vannamei y P. monodon.
Aunque nuestros datos sobre la carga cuantitativa de IHHNV y su efecto sobre el crecimiento son limitados, sugieren una correlación negativa entre estos dos parámetros. Por lo tanto, un conjunto de datos más sólido con una mayor cantidad de muestras junto con el estado de salud de las postlarvas utilizadas para sembrar un estanque será inmensamente beneficioso para una investigación más precisa de una relación cuantitativa entre el crecimiento del camarón y la carga de patógenos de los genotipos circulantes de IHHNV en América Latina.
Ahora que Ud. ha terminado de leer este artículo...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria acuícola mundial y compartir el conocimiento expansivo de nuestra amplia red de colaboradores cada semana.
Al convertirse en miembro de la Global Seafood Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de beneficios, recursos y eventos para miembros pueda continuar. La membresía individual cuesta solo $50 al año.
¿No es miembro de la GSA? Únase a nosotros.
Authors
-

Luis Fernando Aranguren Caro, Ph.D.
Corresponding author
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, Arizona USA[117,100,101,46,97,110,111,122,105,114,97,46,108,105,97,109,101,64,117,103,110,97,114,97,102,108]
-
Muriel Maria Gomez-Sánchez, MVZ
Subdirección de Sanidad, Dirección de Sanidad e Inocuidad (National Fisheries Health Agency in Peru, SANIPES), San Isidro, Lima, Perú
-

Yahira Piedrahita, M.Sc.
Cámara Nacional de Acuacultura, CNA, Guayaquil, Ecuador
-

Hung Nam Mai, Ph.D.
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, Arizona USA
-
Roberto Cruz-Flores, Ph.D.
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, Arizona, USA; and Centro de Investigación Científica y Educación Superior de Ensenada (CICESE), Ensenada, Baja California, México
-

Rod Russel R. Alenton, Ph.D.
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, Arizona, USA
-

Arun K. Dhar, Ph.D.
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, Arizona, USA
Tagged With
Related Posts

Health & Welfare
Desafiando postlarvas de camarón blanco del Pacífico con AHPND
Los resultados del estudio indican que P. vannamei desafiado con AHPND en biofloc tuvo mayores tasas de supervivencia que los camarones desafiados en agua clara.
Health & Welfare
El uso inadecuado de la PCR causa más daño que bien
La prueba de PCR es una herramienta valiosa para detectar patógenos, cuando se lleva a cabo correctamente, pero depender únicamente de ella no es consistente con una bioseguridad adecuada.

Health & Welfare
La historia y el futuro del Laboratorio de Patología Acuícola
El Laboratorio de Patología Acuícola de la Universidad de Arizona ha contribuido significativamente a la expansión de la cría de camarones durante tres décadas.

Health & Welfare
Rendimiento reducido de crecimiento del camarón tigre negro infectado con IHHNV
Este estudio simuló el crecimiento comercial de dos cohortes de P. monodon que diferían en las cargas de infección por IHHNV de sus reproductores, y mostró que la prevalencia viral, la supervivencia y el rendimiento de crecimiento de la progenie en estanques se vieron significativamente afectados.



