Un sistema sinbiótico produjo camarones con mayor supervivencia, rendimiento y menor conversión alimenticia que los sistemas RAS y BFT

El camarón blanco del Pacífico (Penaeus vannamei) es la especie de invertebrado más producida en la industria acuícola mundial, y su producción en regiones continentales con agua de baja salinidad es una realidad en todo el mundo. Esta producción continental es posible gracias a la resistencia de la especie, que le permite soportar un amplio rango de salinidades, temperaturas y densidades de siembra. Esto abre la puerta al cultivo de P. vannamei en sistemas intensivos como los sistemas de acuacultura de recirculación (RAS), de tecnología de biofloc (BFT), y los sistemas sinbióticos.
Estos sistemas permiten obtener un mayor rendimiento a la vez que reducen el consumo de agua y tierra, constituyendo así alternativas respetuosas con el medio ambiente frente a otros sistemas de producción. El sistema RAS requiere condiciones controladas, con un tratamiento del agua que utiliza diversas etapas de filtración mecánica y biológica antes de su recirculación a los tanques de producción. El sistema BFT, de base microbiana, se caracteriza por manipular la relación carbono:nitrógeno (C:N) del agua mediante una fuente de carbono orgánico simple, como la melaza o el azúcar, para controlar el nitrógeno amoniacal total (TAN) estimulando el crecimiento de bacterias heterótrofas. Estos grupos de bacterias asimilan el amoníaco en biomasa, creando agregados microbianos conocidos como bioflóculos.

El sistema sinbiótico ha cobrado relevancia recientemente, con el potencial de ampliar las estrategias de manejo de la fertilización para los cultivos de P. vannamei. Este sistema se caracteriza por fertilizar el agua con salvado vegetal procesado por microorganismos probióticos (por ejemplo, Bacillus, Lactobacillus y levaduras). En los sistemas sinbióticos, el fertilizante mejora la calidad del agua al ayudar a controlar el nitrógeno amoniacal total (TAN), ya que es una fuente de carbono orgánico y, además, un alimento suplementario nutritivo y funcional para los camarones. Esto se debe a que los microorganismos probióticos colonizan las partículas de salvado durante el procesamiento y, al liberarse en el agua, los camarones pueden consumirlas. Las bacterias quimioautótrofas crecen tanto en sistemas de tanques de biofloc (BFT) como en sistemas sinbióticos, desempeñando un papel clave en el control del amoníaco y el nitrito, que son altamente tóxicos en condiciones de baja salinidad.
Dada la expansión del cultivo de P. vannamei a regiones continentales, es importante destacar la falta de estudios comparativos entre los sistemas de recirculación acuícola, los sistemas BFT y los sistemas sinbióticos que utilizan agua de baja salinidad; así como su impacto en el control de los compuestos nitrogenados, la composición microbiana y el crecimiento de los camarones.
Las investigaciones desde esta perspectiva son importantes para superar las barreras que plantea el cultivo de camarón en estas condiciones únicas. Por lo tanto, el objetivo de este estudio fue analizar el efecto de los sistemas RAS, BFT y sinbióticos sobre la calidad del agua, la composición del plancton y el crecimiento de P. vannamei en agua con una salinidad de 2 gramos por litro y alta densidad de siembra.
Los autores agradecen profundamente el apoyo financiero brindado por la Coordinación de Perfeccionamiento del Personal de Nivel Superior (CAPES), el Consejo Nacional de Desarrollo Científico y Tecnológico (CNPq), la Fundación de Apoyo a la Investigación del Estado de Rio Grande do Sul – FAPERGS y todo el equipo de VSAREC.
Configuración del estudio
Este estudio se llevó a cabo en el Centro de Investigación y Extensión Agrícola de Productos del Mar de Virginia (VSAREC), perteneciente al Instituto Politécnico y Universidad Estatal de Virginia (Virginia, EE. UU.) (Fig. 1a). Se cultivó Penaeus vannamei a una densidad de 500 camarones por metro cúbico (peso inicial: 1,27 ± 0,06 gramos) durante 30 días en unidades experimentales de 0,1 metros cúbicos, evaluando los siguientes tratamientos, cada uno con tres repeticiones: sistema de acuacultura de recirculación (RAS), sistema de tecnología de biofloc (BFT) y sistema sinbiótico (Fig. 1b). El agua utilizada en el experimento se obtuvo mezclando agua potable declorada con sal artificial comercial (Instant Ocean Sea Salt) hasta alcanzar una salinidad de 2 gramos por litro.

El sistema RAS tenía un volumen total de 0,6 metros cúbicos y el agua se recirculaba constantemente a un caudal aproximado de 180 litros por hora. Se trataba mediante filtración mecánica con un filtro de perlas de burbujas y filtración biológica (un depósito con medio biológico K1 Kaldnes con aireación constante) antes de regresar a las unidades experimentales. Se realizaban retrolavados semanales para limpiar el filtro mecánico. Antes de introducir los camarones, el sistema RAS se acondicionó mediante dos aplicaciones de 5 mg/L de cloruro de amonio (NH₄Cl) durante 10 días.
El tratamiento BFT era estático y utilizaba agua reutilizada de un cultivo previo de P. vannamei con una salinidad de 28 g/L, la cual se aclimató gradualmente a una salinidad de 2 g/L durante 13 días. Se utilizó dextrosa como fuente de carbono y se aplicó en una proporción C:N de 15:1 solo cuando el nitrógeno amoniacal total (TAN) era igual o superior a 1 mg/L. Los tratamientos RAS y BFT recibieron aplicaciones semanales de un probiótico comercial (Sanolife Mic, INVE Aquaculture) a una concentración de 0,4 g/m³.
Estimación de sólidos suspendidos totales en bioflocs por turbidez
El tratamiento sinbiótico también fue estático y se maduró con 16 aplicaciones diarias de salvado de arroz procesado antes de la siembra de los camarones. El fertilizante sinbiótico consistió en salvado de arroz (20 g/m³), el mismo probiótico comercial (0,4 g/m³), dextrosa (2 g/m³), bicarbonato de sodio (2 g/m³) y agua con una salinidad de 2 g/L en una proporción 10:1 [volumen de agua limpia (L): peso del salvado de arroz (kg)]. El fertilizante se procesó mediante una fase anaeróbica de 12 horas, seguida de una fase aeróbica de 12 horas, y posteriormente se aplicó al sistema. Además de fertilizantes orgánicos, el tratamiento sinbiótico recibió aplicaciones diarias de 1 mg/L de NH₄Cl como fuente de nitrógeno inorgánico para favorecer el establecimiento de bacterias nitrificantes. Durante el ensayo, se aplicaron fertilizantes diariamente durante los primeros 15 días y, posteriormente, tres veces por semana. Los tratamientos BFT y sinbiótico recibieron almohadillas de 15 × 15 cm con sustratos artificiales (K1 Kaldnes Biological Media) para favorecer la nitrificación. En todos los tratamientos, la temperatura del agua se mantuvo alrededor de 30 grados-C mediante calentadores.
Durante el ensayo, los camarones se alimentaron dos veces al día con una dieta comercial con un 35 por ciento de proteína bruta (Zeigler Bros). Se monitorearon los compuestos nitrogenados, las concentraciones de calcio y magnesio, y la relación Mg:Ca. Se realizaron recambios de agua del 10 por ciento del volumen en las unidades experimentales cuando el nitrógeno amoniacal total (TAN) superó 1 mg/L. Al finalizar el ensayo, se identificaron y cuantificaron los principales grupos de microorganismos zooplanctónicos presentes en el agua.
Resultados y discusión
Al inicio del ensayo, la concentración de calcio varió entre 90 mg/L en el tratamiento sinbiótico y 100 mg/L en el sistema RAS, y la de magnesio entre 90 mg/L en el sistema RAS y 140 mg/L en el tratamiento BFT. La relación Mg:Ca varió de 0,9:1 en el sistema RAS a 1,68:1 en el tratamiento BFT. Al finalizar el ensayo, la concentración de calcio fue de 110 mg/L en el sistema RAS, 80 mg/L en el sistema BFT y 90 mg/L en el tratamiento sinbiótico. La concentración de magnesio fue de 120 mg/L en el sistema RAS, 100 mg/L en el sistema BFT y 130 mg/L en el tratamiento sinbiótico. La relación Ca:Mg fue de 1,09:1 en el sistema RAS, 1,26:1 en el sistema BFT y 1,44:1 en el tratamiento sinbiótico. Tanto al inicio como al final del ensayo, las concentraciones de iones de calcio y magnesio superaron el umbral recomendado para el cultivo intensivo de Penaeus vannamei en agua de baja salinidad, que es de 25 mg/L para el calcio y 89 mg/L para el magnesio. Si bien la relación Mg:Ca no se ajustó a la relación recomendada de 3:1, esto no afectó negativamente el crecimiento de los camarones durante el ensayo.
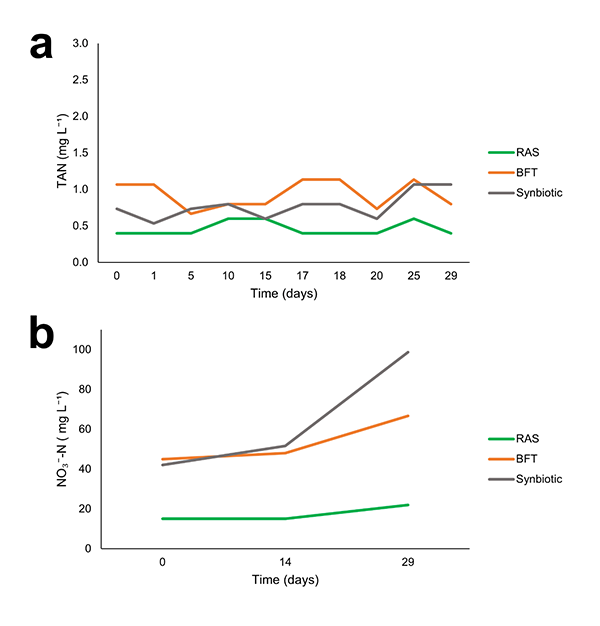
El TAN promedio fue mayor en los tratamientos BFT (0,83 mg/L) y sinbiótico (0,75 mg/L) que en el RAS (0,42 mg/L). En el sistema BFT se observaron más episodios con concentraciones de nitrógeno amoniacal total (TAN) superiores a 1 mg/L (Fig. 2a), lo que requirió cambios parciales de agua e indicó que la comunidad bacteriana oxidante de amoníaco aún no estaba completamente establecida.
En los sistemas de cultivo de camarón con agua de baja salinidad, la toxicidad del amoníaco y los nitritos es elevada, y el sistema debe estar completamente maduro para evitar picos de concentración, que pueden ser perjudiciales. A pesar de los picos de amoníaco en el sistema BFT, los nitritos se mantuvieron estables durante todo el ensayo, con concentraciones medias inferiores a 0,50 mg/L. La concentración media de nitrato fue mayor en los tratamientos BFT (53,93 mg/L) y sinbiótico (61,27 mg/L) que en el tratamiento RAS (17,80 mg/L). En los tratamientos BFT y sinbiótico, se observó acumulación de nitratos durante todo el ensayo, especialmente en el tratamiento sinbiótico (Fig. 2b), lo que demuestra la alta actividad de las bacterias nitrificantes en estos tratamientos, en particular de las bacterias oxidantes de nitrito.
Este grupo de bacterias es responsable de la oxidación del nitrito a nitrato. Los menores niveles de nitrato en el RAS se explican por los retrolavados semanales para limpiar el filtro mecánico, que desechaban gran parte del nitrato producido en el sistema. Los resultados de este estudio demostraron que el sistema sinbiótico fue más eficiente en el control de compuestos nitrogenados que el BFT en sistemas de cultivo superintensivo de camarón con agua de baja salinidad, ya que requirió menos cambios de agua, presentó bajas concentraciones de nitrito (sin picos) y resultó en una mayor acumulación de nitrato. Esto solo fue posible mediante el protocolo de maduración del tratamiento sinbiótico, que incluyó fertilización orgánica diaria con salvado de arroz procesado por microorganismos probióticos, combinada con fertilización con una fuente de nitrógeno inorgánico hasta la estabilización de los compuestos nitrogenados.
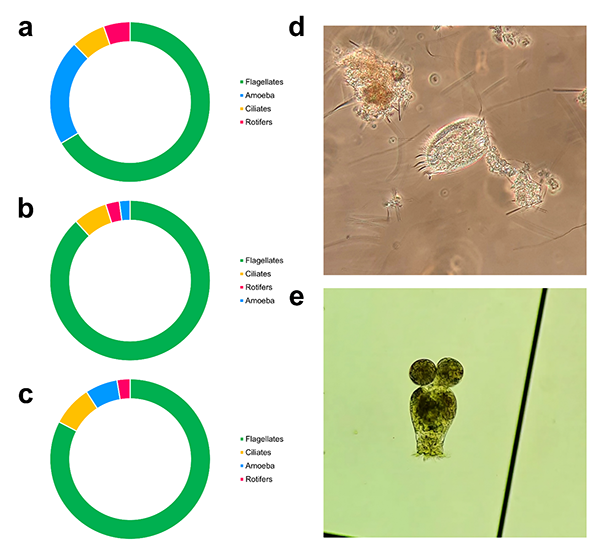
El sistema sinbiótico presentó una mayor abundancia de ciliados y amebas que los sistemas RAS y BFT. En todos los tratamientos predominaron los protozoos flagelados. El tratamiento RAS presentó la mayor abundancia relativa de amebas (21 por ciento). Los ciliados representaron el 6,8 por ciento del zooplancton total en los tratamientos RAS y BFT, y el 8 por ciento en el tratamiento simbiótico (Fig. 3).
Los rotíferos representaron el 5 % de la abundancia total de zooplancton en el tratamiento RAS, el 2,7 por ciento en el tratamiento BFT y el 2,6 por ciento en el tratamiento simbiótico (Fig. 3).
La presencia de microorganismos protozoarios indicó un predominio heterótrofo, una característica distintiva tanto del sistema BFT como del sinbiótico. El crecimiento de los protozoos está mediado por la presencia de bacterias, que constituyen su principal fuente de alimento. Este predominio se estimula para garantizar un mayor control del fitoplancton, la calidad del agua y el ciclo de nutrientes. En general, los sistemas BFT y sinbiótico presentaron una mayor abundancia de microorganismos que el sistema RAS, lo cual era de esperar debido a las características operativas de los sistemas de cultivo.
La presencia constante de microorganismos en el medio de cultivo representa una ventaja para los sistemas BFT y simbiótico, lo que influyó directamente en los índices de producción de P. vannamei. El peso final de los camarones fue mayor en los tratamientos BFT (5,14 gramos) y sinbiótico (4,99 gramos) que en el sistema RAS (4,45 gramos) (Fig. 4a). La supervivencia fue mayor en el sistema sinbiótico (98 por ciento) que en los sistemas RAS (80,67 por ciento) y BFT (85,33 por ciento) (Fig. 4b).
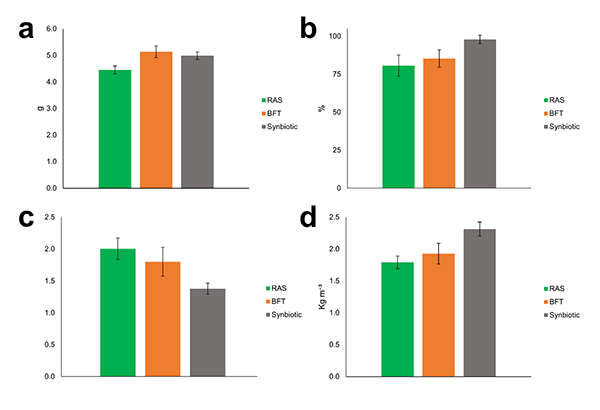
El FCR fue mayor en RAS (2,01) y BFT (1,80) que en el sinbiótico (1,38) (Fig. 4c). El rendimiento fue mayor en el sinbiótico (2,31 kg/m³) que en RAS (1,79 kg/m³) y BFT (1,93 kg/m³) (Fig. 4d).
Los resultados demostraron el efecto positivo de los microorganismos como fuente suplementaria de alimento natural para el camarón, mejorando el crecimiento, la supervivencia y el estado inmunitario de los animales, reduciendo los costos de alimentación e incrementando el rendimiento. Este efecto fue más notable en el tratamiento sinbiótico. Además, el tratamiento que empleó el sistema sinbiótico presentó un beneficio adicional: la aplicación de salvado de arroz procesado como fertilizante, que también proporcionó una fuente suplementaria de alimento natural altamente nutritiva y funcional, ya que es rica en microorganismos probióticos.
Considerar estos factores es de suma importancia al cultivar camarón marino en aguas de baja salinidad, dado que este es un entorno adverso para los animales. Por lo tanto, la creación de condiciones más favorables en cuanto a la calidad del agua y la presencia de alimento natural suplementario son alternativas para el cultivo superintensivo de P. vannamei en regiones continentales con aguas de baja salinidad. Es importante destacar que estos resultados representan un período de crecimiento corto y que se debe realizar un ciclo completo para confirmar los efectos positivos del sistema simbiótico en el cultivo superintensivo de P. vannamei.
Conclusión
El sistema sinbiótico se considera una estrategia prometedora para el cultivo superintensivo de P. vannamei en agua de baja salinidad, ya que proporcionó un mejor control de los compuestos nitrogenados en comparación con el sistema BFT y una mayor abundancia de microorganismos zooplanctónicos, como ciliados y amebas, que los sistemas RAS y BFT. Además, el sistema sinbiótico produjo camarones con mayor supervivencia, rendimiento y un índice de conversión alimenticia (FCR) más bajo que de los sistemas RAS y BFT.
Ahora que Ud. ha llegado al final del artículo...
… por favor considere apoyar la misión de la GSA de promover prácticas responsables de productos del mar a través de la educación, la defensa y las garantías de terceros. El Advocate tiene como objetivo documentar la evolución de las prácticas responsables de productos del mar y compartir el amplio conocimiento de nuestra amplia red de colaboradores.
Al hacerse miembro de la Global Seafood Alliance, está asegurando de que todo el trabajo pre-competitivo que hacemos a través de los beneficios, recursos y eventos para miembros pueden continuar. La membresía individual cuesta solo $50 al año.
¿No es miembro de la GSA? Únase a nosotros.
Authors
-
Otávio Augusto Lacerda Ferreira Pimentel, Ph.D.
Corresponding author
Departamento de Pesca e Aquicultura, Universidade Federal Rural de Pernambuco, Recife, Brazil[109,111,99,46,111,111,104,97,121,64,108,101,116,110,101,109,105,112,46,111,105,118,97,116,111]
-
Michael H. Schwarz, Ph.D.
Virginia Seafood Agricultural Research and Extension Center, Virginia Polytechnic Institute and State University, Hampton, VA, USA
-
Jonathan van Senten, Ph.D.
Virginia Seafood Agricultural Research and Extension Center, Virginia Polytechnic Institute and State University, Hampton, VA, USA
-
Wilson Wasielesky, Ph.D.
Estação Marinha de Aquacultura, Instituto de Oceanografia, Universidade Federal do Rio Grande - FURG, Rio Grande, Brazil
-
Stephen Urick
Virginia Seafood Agricultural Research and Extension Center, Virginia Polytechnic Institute and State University, Hampton, VA, USA
-
Andrezza Carvalho, Ph.D.
Estação Marinha de Aquacultura, Instituto de Oceanografia, Universidade Federal do Rio Grande - FURG, Rio Grande, Brazil
-
Ethan McAlhaney, B.S.
Virginia Seafood Agricultural Research and Extension Center, Virginia Polytechnic Institute and State University, Hampton, VA, USA
-
Jireh Clarington, B.S.
Virginia Seafood Agricultural Research and Extension Center, Virginia Polytechnic Institute and State University, Hampton, VA, USA
-
Dariano Krummenauer, Ph.D.
Estação Marinha de Aquacultura, Instituto de Oceanografia, Universidade Federal do Rio Grande - FURG, Rio Grande, Brazil
Tagged With
Related Posts

Responsibility
Beneficios y desafíos potenciales de las microalgas en el tratamiento de aguas residuales de la acuacultura
La integración del cultivo de microalgas con la acuacultura permite el aprovechamiento de las aguas acuícolas residuales para producir valiosos productos de origen biológico.

Health & Welfare
Construyendo un mejor pre-criadero de camarones, parte 1
Los sistemas de pre-criadero de camarones ofrecen una oportunidad importante para aumentar los beneficios. Los pre-criaderos adecuadamente diseñados y operados son instalaciones altamente bioseguras para criar postlarvas a densidades muy altas. El objetivo es producir juveniles fuertes, sanos y uniformes con un potencial significativo de crecimiento compensatorio después de su transferencia para el crecimiento final en estanques.

Intelligence
Encuesta sobre prácticas de gestión dirigida a productores y expertos Europeos en camarones
El estudio busca aumentar la concienciación y el conocimiento sobre el engorde de camarones para mejorar la calidad del producto, optimizar la eficiencia y abordar el bienestar animal.

Health & Welfare
Supervivencia de juveniles de camarón blanco del Pacífico después de exposición a niveles críticos de oxígeno en cultivo de biofloc
Un estudio en Brasil evaluó la supervivencia de juveniles de camarón blanco del Pacífico después de su exposición a niveles críticos de oxígeno en condiciones de cultivo en biofloc.


![Ad for [Aquademia]](https://www.globalseafood.org/wp-content/uploads/2025/07/aquademia_web2025_1050x125.gif)
