Los resultados muestran por primera vez que los hilos fecales de camarones pueden ser una ruta de contaminación infecciosa

La enfermedad Hepatopancreatic Microsporidiosis (HPM), causada por el microsporidio intracelular Enterocytozoon hepatopenaei (EHP), se ha informado en varios camarones peneidos, incluido el camarón tigre negro (Penaeus monodon) y el camarón blanco del Pacífico (P. vannamei). Se ha reportado EHP en diferentes regiones, incluidos países asiáticos como China, Indonesia, Malasia, Vietnam, Tailandia e India. Recientemente, también se ha reportado EHP en Venezuela en el hemisferio occidental.
El EHP causa lesiones en las células epiteliales del túbulo del hepatopáncreas (HP), y su principal signo clínico es el retraso del crecimiento que conduce a una mayor variabilidad de tamaño. Los hilos fecales blanquecinos que flotan en la superficie del agua del estanque y la presencia de camarones que muestran una decoloración blanca del tracto gastrointestinal (tracto GI) en estos estanques también se han asociado con EHP. En etapas avanzadas de la enfermedad, los camarones infectados con EHP generalmente muestran caparazones blandos, letargo, consumo reducido de alimento, intestino medio vacío y mortalidad crónica.
En países donde se ha reportado EHP – como India, China, Vietnam y Venezuela – el cultivo de camarón se lleva a cabo en una amplia gama de condiciones ambientales, incluidas áreas marinas costeras, áreas estuarinas y áreas del interior. Por ejemplo, en algunos estados de la parte oriental de la India, como Andhra Pradesh, los estanques se llenan con agua de pozo mezclada con agua de estuario, lo que hace que la salinidad de los estanques de crecimiento fluctúe entre 0 y 30 ppt con una salinidad promedio de unos 10 ppt. Por el contrario, en estados ubicados en la parte occidental del país, como Gujarat, la salinidad en el agua de los estanques puede variar entre 30 y 44 ppt. En el noroeste de Venezuela, algunas granjas camaroneras están ubicadas alrededor del lago de Maracaibo, donde la salinidad oscila entre 2 y 5 ppt, mientras que en el noreste de Venezuela las granjas camaroneras están ubicadas en un ambiente marino donde la salinidad oscila entre 20 y 40 ppt, y EHP ha sido reportado en ambos ambientes de alta y baja salinidad. En ambos países, la incidencia de EHP parece ser mayor en ambientes de alta salinidad, pero hasta ahora ningún estudio ha evaluado la posible relación entre la salinidad y la presencia de EHP.
Este artículo – adaptado y resumido de la publicación original [Aranguren Caro, L.F. et al. 2021. The effect of salinity on Enterocytozoon hepatopenaei infection in Penaeus vannamei under experimental conditions. BMC Vet Res 17, 65 (2021)] – informa sobre los resultados de un estudio para comparar la infectividad de EHP utilizando hilos fecales como inóculo en tres salinidades diferentes en condiciones experimentales.
Configuración del estudio
Los bioensayos se realizaron en el Laboratorio de Patología Acuícola (UA-APL) de la Universidad de Arizona. Se obtuvieron P. vannamei libres de patógenos específicos (SPF) de un proveedor comercial en Florida, EE. UU. La población SPF ha sido pesquisada durante los últimos dos años en la UA-APL sin presencia de ninguna de las enfermedades listadas y no listadas por la Organización Mundial de Sanidad Animal (OIE), incluyendo EHP.
El aislado de EHP utilizado en este estudio se obtuvo de una población de P. vannamei originaria de Tailandia. Se realizaron dos desafíos EHP independientes. En ambos desafíos, los camarones se mantuvieron a tres salinidades diferentes de 2 ppt, 15 ppt y 30 ppt. Para cada desafío experimental, se llenaron seis tanques de 90 litros con agua de mar artificial que correspondía a los tres niveles de salinidad con dos repeticiones para cada tratamiento de salinidad. La temperatura se ajustó a 25 grados-C (±0,6) con mediciones cada mañana; el pH se midió una vez por semana con un rango de 7,5 a 8,0.
La salinidad se ajustó cambiando tres partes de la salinidad cada hora desde 25 ppt (salinidad inicial de la población SPF de P. vannamei) hasta 5 ppt. Para lograr una salinidad de 2 ppt desde 5 ppt, la parte de salinidad se cambió cada dos horas. Una vez configurada, se midió la salinidad con un refractómetro de sal una vez por semana durante la duración de los desafíos. Se sembraron diez (10) SPF P. vannamei (2.0–2.1 gramos) en cada tanque para la infección experimental, respectivamente. Se instalaron tres tanques de control de 90 litros para cada salinidad como tratamiento de control negativo.
Para obtener información detallada sobre el diseño experimental y la cría de animales; preparación de inóculo; pruebas de histopatología y reacción en cadena de la polimerasa para la detección y cuantificación de EHP; y análisis estadísticos, consulte la publicación original.
Resultados y discusión
Investigamos la prevalencia y la gravedad de EHP en tres salinidades: alta (30 ppt), media (15 ppt) y baja (2 ppt) en condiciones de laboratorio. Los hilos fecales utilizados como fuente de inóculos de EHP en los desafíos experimentales fueron suficientes para causar la enfermedad en camarones mantenidos a diferentes salinidades, según lo confirmado por histopatología y PCR. Los resultados de este estudio proporcionan un nuevo método de infección por EHP a través de hilos fecales por vía fecal-oral.
La supervivencia final al terminar el desafío EHP fue alta, con un rango de 90 a 100 por ciento, en las tres salinidades en cada uno de los dos desafíos experimentales independientes (Tabla 1). Los porcentajes de supervivencia en los tratamientos de control fueron del 100 por ciento en todas las salinidades en los dos experimentos de desafío independientes. No observamos ningún signo clínico en los camarones expuestos a EHP en las 3 salinidades diferentes.
Aranguren, Salinidad, Tabla 1
| Desafío experimental | Duración | Tratamiento 2 ppt EHP | Control 2 ppt | Tratamiento 15 ppt EHP | Control 15 ppt | Tratamiento 30 ppt EHP | Control 30 ppt |
|---|---|---|---|---|---|---|---|
| 1 | 20 días | 95 ± 7 | 100 ± 0 | 100 ± 0 | 100 ± 0 | 100 ± 0 | 100 ± 0 |
| 2 | 26 días | 90 ± 0 | 100 ± 0 | 100 ± 0 | 100 ± 0 | 90 ± 7 | 100 ± 0 |
Las hebras fecales se recolectaron diariamente de tanques conocidos como infectados con EHP. Las muestras diarias de heces fecales dieron positivas para EHP en ambos desafíos. El peso promedio de las hebras fecales agregadas a cada tanque fue de 1.17 ± 0.52 gramos y 0.32 ± 0.24 gramos para los desafíos 1 y 2, respectivamente. El número de copias de EHP en las hebras fecales utilizadas como inóculo fue significativamente mayor en el desafío n.º 2 (p < 0,05). El número de copias de EHP en la hebra fecal en el desafío 1 fue de 1,6 × 103 ± 2,1 × 103 copias/ng de ADN en comparación con 1,1 × 106 ± 2,0 × 106 copias/ng de ADN en el inóculo del desafío 2.
La prevalencia y la gravedad de EHP en los camarones que desafiamos experimentalmente usando hebras fecales como inóculos en los dos desafíos independientes se evaluaron mediante histología de H&E. En ambos desafíos experimentales, las hebras fecales utilizadas como inóculo fueron capaces de provocar la enfermedad en camarones SPF. La prevalencia de EHP fue del 28,5 por ciento en el desafío 1 frente al 50,0 por ciento en el desafío 2. Los datos confirman que las hebras fecales son una fuente confiable de inóculo para la infección experimental de EHP.
La prevalencia de EHP a salinidades de 2 ppt, 15 ppt y 30 ppt en el desafío 1 fue del 25, 33,3 y 25 por ciento, respectivamente. En el desafío 2, la prevalencia de EHP a 2 ppt, 15 ppt y 30 ppt fue de 33,3, 30,0 y 87,5 por ciento, respectivamente. El grado de severidad fue mayor a una salinidad de 30 ppt en el segundo experimento. En el desafío 2, el 50 por ciento de la población infectada con EHP a 30 ppt mostró lesiones de grado G3 (moderadas a graves) y G4 (graves) causadas por la infección por EHP. Encontramos una fuerte asociación entre las salinidades y los camarones infectados con EHP, y la prevalencia de EHP en camarones expuestos a alta salinidad (30 ppt) fue mayor que en camarones expuestos a baja salinidad (2 ppt y 15 ppt combinados). Los diferentes grados de severidad en este estudio se muestran en la Figura 1.
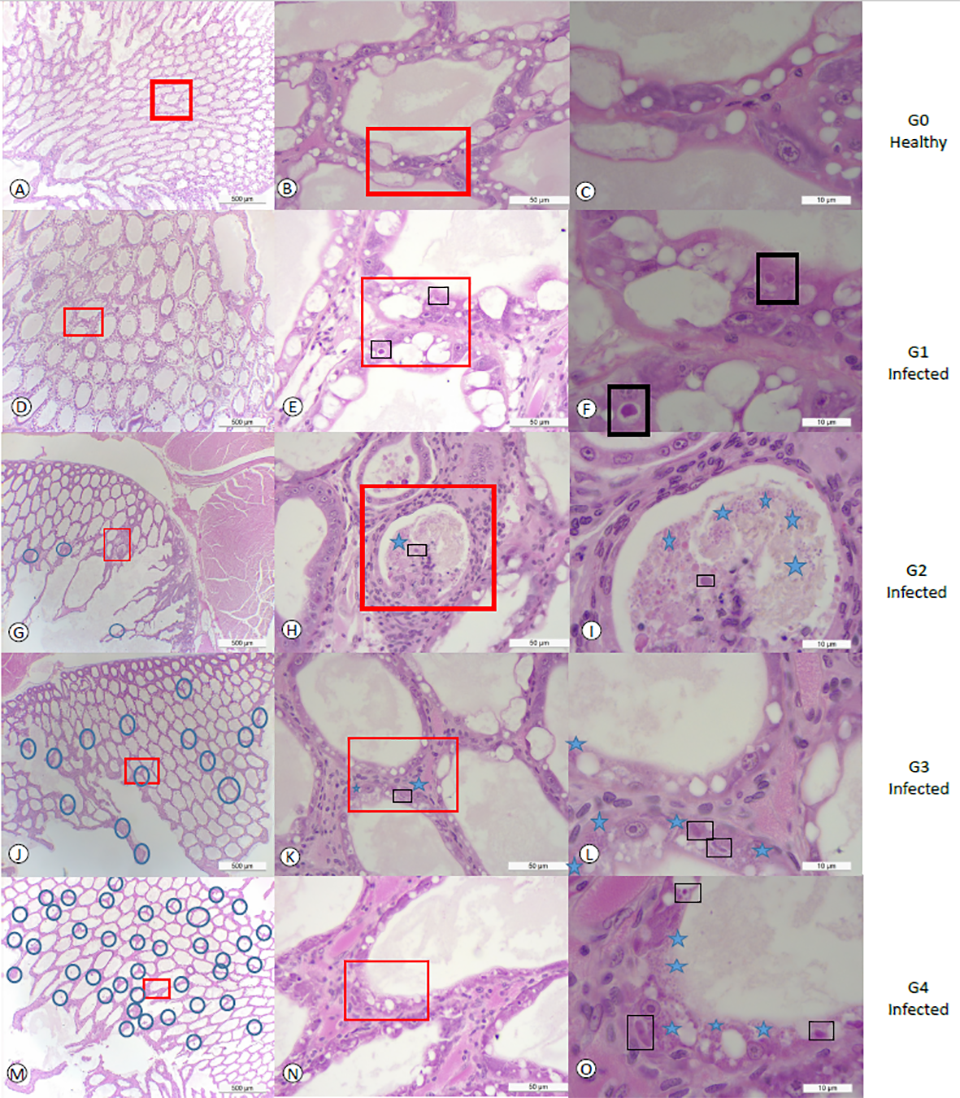
Los paneles A, B y C de la Fig. 1 muestran secciones de tejido de HP con una magnificación baja, media y alta de camarones sanos del tanque de control sin mostrar ninguna lesión histológica de EHP ni ningún otro patógeno conocido. Por el contrario, los paneles D, E y F muestran secciones de tejido HP que muestran el grado G1 de una infección por EHP. Se observó una región focalizada dentro del HP (Fig. 1d). El túbulo afectado muestra los cuerpos de inclusión citoplásmicos distintivos en el citoplasma de las células del túbulo epitelial afectado que corresponden a la etapa de meront uninucleado (Fig. 1e-f). Los paneles G, H e I de la Fig. 1 muestran el grado G2 de una infección por EHP (de baja a moderada). Se observó la presencia focal de una infección por EHP en pocas células epiteliales de los túbulos HP afectados. Se observaron tanto la etapa de meront como las esporas liberadas en el lumen (Fig. 1i). Los paneles J, K y L de la Fig. 1 muestran un grado G3 típico de una infección por EHP.
Se observaron lesiones multifocales en las células epiteliales de los túbulos HP (Fig. 1j). En los túbulos afectados se observó la presencia tanto de plasmodio multinucleado irregular como de esporas dentro del citoplasma de las células del epitelio cuticular (fig. 1). Los paneles M, N y O de la Fig. 1 muestran el grado G4 de una infección por EHP con túbulos multifocales que contienen células HP infectadas (Fig. 1m). Se observaron tanto plasmodio multinucleado como esporas dentro del citoplasma de las células afectadas, así como esporas dentro de la luz de los túbulos (Fig. 1o).
El hepatopáncreas de los camarones SPF desafiados con hebras fecales obtenidas de camarones infectados con EHP tuvo resultados positivos para EHP usando PCR anidada en todos los tanques en las tres salinidades diferentes. Esto confirma la presencia de EHP en los tanques de tratamiento para el desafío 1 y el desafío 2. Se detectó EHP en las tres salinidades evaluadas (2 ppt, 15 ppt y 30 ppt). El tejido de hepatopáncreas recolectado de los animales del tratamiento de control negativo criados con salinidades de 2 ppt, 15 ppt y 30 ppt resultó negativo para EHP usando PCR anidada.
Estudios previos han demostrado que algunas rutas de infección incluyen la cohabitación, la sonda inversa y la inyección directa en el hepatopáncreas con inóculo de EHP. En este estudio, informamos por primera vez que las heces pueden ser una ruta de contaminación infecciosa. Debido al comportamiento detritívoro y a la presencia de alimento no digerido dentro de las heces que podría estar entre el 25 y el 30 por ciento, los camarones en los tanques de tratamiento consumían esta fuente de alimento junto con las esporas infectadas con EHP que imitaban la transmisión horizontal observada a nivel de granja.
Lesiones de EHP, incluida la presencia de plasmodio en el citoplasma de las células infectadas; y encontramos esporas maduras dentro del citoplasma o esporas liberadas en la luz por histopatología en camarones desafiados con EHP criados a diferentes salinidades. Esto confirma inequívocamente que EHP puede causar una infección en una amplia gama de salinidades, que varían tanto como 2 ppt a 30 ppt. Cuando el inóculo inicial utilizado para el desafío experimental fue bajo (es decir, 1 × 103 copias de EHP/ng de ADN fecal total), la prevalencia de HPM fue similar (es decir, 25 por ciento) independientemente de la salinidad.
Sin embargo, la prevalencia de la infección por EHP aumentó a 30 ppt de salinidad (87,5 por ciento de prevalencia), en comparación con 15 ppt (30,0 por ciento de prevalencia) y 2 ppt de salinidad (33,3 por ciento de prevalencia), cuando el nivel de inóculo aumentó de 1 × 103 a 1 × 106 copias de EHP/ng de ADN fecal total en el experimento de desafío (es decir, desafío 2). El desafío dependiente de la dosis ha sido bien documentado para otros patógenos de camarones como AHPND y Hepatobacter penaei. En el presente estudio, el inóculo con bajo número de copias (1,6 × 103 copias de EHP/ng de ADN fecal total) utilizado en el desafío 1 causó infecciones leves en los camarones desafiados. Sin embargo, se produjeron infecciones graves (Grados G3 a G4) y una mayor prevalencia en el desafío 2 cuando el número de copias de EHP en el inóculo fue mayor (1,1 × 106 copias de EHP/ng de ADN fecal total).
Ingredientes funcionales impulsan la innovación de alimentos para camarones
Las lesiones histológicas en camarones mantenidos a 30 ppt de salinidad fueron más severas. Se encontró un grado de infección de moderado a severo (G3-G4) en el 50 por ciento de los camarones afectados. En contraste, solo el 16 por ciento de los camarones criados a una salinidad de 2 ppt mostró un nivel de infección de grado G3 y el 0 por ciento de los camarones criados a una salinidad de 15 ppt mostró un nivel de infección de grado G2-G4. La diferencia en la severidad de la infección por EHP en las tres salinidades diferentes probablemente se debió al efecto diferencial de la salinidad en la germinación de esporas. Una de las fases críticas en la germinación de las esporas es el aumento de la presión osmótica intra-esporas. La diferencia en las salinidades condujo a un ambiente hipotónico (menor concentración) a 2 ppt y 15 ppt en comparación con un ambiente hipertónico (mayor concentración) a 30 ppt. Es posible que la solución hipertónica mejore la germinación de la espora aumentando el proceso de activación de la espora.
La dureza del agua es otra variable que fue diferente en las tres salinidades utilizadas en este estudio y pudo haber sido un factor que afectó la germinación de las esporas. La dureza en baja salinidad (2 ppt) fue de unos 240 mg/L vs el agua marina preparada artificialmente a 15 ppt y 30 ppt que rondaron los 787 y 1575 mg/L, respectivamente. Se ha reportado que el calcio es un segundo mensajero importante que activa muchos eventos celulares y que la entrada de calcio podría ser, en parte, responsable de la activación de la descarga de esporas de microsporidios a salinidades más altas.
En los estanques de engorde de algunas áreas endémicas de EHP en Asia, las condiciones de salinidad varían ampliamente. Por ejemplo, en India hay algunas áreas de cultivo de camarón en salinidad alta y baja, y la prevalencia de EHP parece ser menor en salinidades más bajas (por debajo de 5 ppt), como se observó durante una encuesta sobre la enfermedad del camarón en Andhra Pradesh en 2019. Condiciones similares se registraron en dos áreas importantes de cultivo de camarón en Venezuela, a saber, el lago de Maracaibo, donde la salinidad es de alrededor de 4–6 ppt y en el estado Falcón, donde la salinidad varía de 36 a 40 ppt. En Venezuela, la camaronicultura no está completamente integrada y el movimiento de nauplios y postlarvas entre el estado de Falcón y el área del Lago de Maracaibo es una práctica común. Esto sugiere que las PL y/o los reproductores infectados con EHP se han movido entre estas dos zonas. Sin embargo, EHP solo se ha detectado en el área de Falcón, donde las salinidades son altas. En el lago de Maracaibo, donde los niveles de salinidad son bajos, no se ha reportado EHP. Una posibilidad que ha limitado la propagación de EHP podría ser la diferencia en la salinidad del agua.
Conclusión
Los resultados de nuestro estudio demostraron que las hebras fecales de camarones infectados con EHP podrían usarse como una fuente confiable de inóculo para realizar infecciones experimentales de EHP a través de la ruta fecal-oral. Una infección por EHP puede ocurrir a baja salinidad (es decir, 2 ppt), aunque la prevalencia y la gravedad de la infección son mayores a una salinidad de 30 ppt. Estos hallazgos tienen implicaciones en el manejo de enfermedades en áreas endémicas de EHP.
Ahora que Ud. ha terminado de leer este artículo...
… esperamos que considere apoyar nuestra misión de documentar la evolución de la industria acuícola mundial y compartir el conocimiento expansivo de nuestra amplia red de colaboradores cada semana.
Al convertirse en miembro de la Global Seafood Alliance, se asegura de que todo el trabajo pre-competitivo que realizamos a través de beneficios, recursos y eventos para miembros pueda continuar. La membresía individual cuesta solo $50 al año.
¿No es miembro de la GSA? Únase a nosotros.
Authors
-

Luis Fernando Aranguren Caro, Ph.D.
Corresponding author
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, AZ 85721 USA[32,117,100,101,46,97,110,111,122,105,114,97,64,117,103,110,97,114,97,102,108]
-
F. Alghamdi
Health & Fisheries Services Ministry of Environment, Water and Agriculture, 65 King Abdulaziz Road, Riyadh, 11195, Kingdom of Saudi Arabia
-
K. De Belder
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, AZ 85721 USA
-
J. Lin
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, AZ 85721 USA
-
H.N. Mai
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, AZ 85721 USA
-
J. Millabas
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, AZ 85721 USA
-
Y. Alrehaili
Health & Fisheries Services Ministry of Environment, Water and Agriculture, 65 King Abdulaziz Road, Riyadh, 11195, Kingdom of Saudi Arabia
-
A. Alazwari
Health & Fisheries Services Ministry of Environment, Water and Agriculture, 65 King Abdulaziz Road, Riyadh, 11195, Kingdom of Saudi Arabia
-
S. Algetham
Health & Fisheries Services Ministry of Environment, Water and Agriculture, 65 King Abdulaziz Road, Riyadh, 11195, Kingdom of Saudi Arabia
-

Arun K. Dhar, Ph.D.
Aquaculture Pathology Laboratory, School of Animal and Comparative Biomedical Sciences, The University of Arizona, Tucson, AZ 85721 USA
Tagged With
Related Posts

Health & Welfare
Desafiando postlarvas de camarón blanco del Pacífico con AHPND
Los resultados del estudio indican que P. vannamei desafiado con AHPND en biofloc tuvo mayores tasas de supervivencia que los camarones desafiados en agua clara.

Health & Welfare
EHP es un factor de riesgo para otras enfermedades del camarón
Desafíos de laboratorio y un estudio caso-control se utilizaron para determinar los efectos de la infección por EHP en dos enfermedades de Vibrio: necrosis hepatopancreática aguda (AHPND) y necrosis hepatopancreática séptica (SHPN).

Health & Welfare
Síndrome de Heces Blancas en Camarones: ¿Predictor de EHP?
Un estudio demuestra una fuerte asociación entre el Síndrome de las Heces Blancas y Enterocytozoon hepatopenaei en regiones endémicas de EHP. Las estrategias de bioseguridad pueden minimizar el riesgo de propagación de patógenos en las Américas.

Intelligence
Temas de producción actuales en la cría de camarones, parte 1
Se necesita más I + D e inversión para abordar diversos temas actuales en la cría de camarones, incluida la mejora genética, los requisitos nutricionales y los ingredientes de los ingredientes, la gestión de la salud y otros temas.



