Investigadores notan mayor supervivencia y signos histológicos de regeneración de hepatopáncreas en pruebas en Vietnam con INVE

El síndrome de la mortalidad temprana (EMS) es un síndrome de gestión. Una combinación de factores adversos en la nutrición, la bioseguridad, la fisiología del huésped, y especialmente la gestión microbiana conduce a una situación en la que los agentes patógenos oportunistas tales como Vibrio parahaemolyticus pueden florecer y dominar la microbiota alrededor y dentro de los camarones. Cuando factores de virulencia adicionales, tales como la colonización del estómago y la producción de toxina se añaden a esta situación, las enfermedades como la necrosis aguda del hepatopáncreas (AHNPD) causarán pérdidas graves.
INVE Aquaculture ya ha estado trabajando en este tema desde hace más de una década, en el contexto de la vibriosis “tradicional.” Por ello, era un paso lógico el extrapolar nuestros tratamientos pro- y metafilácticos establecidos para esta nueva variante de Vibrio. Al aplicar nuestros probióticos en el campo, como parte de un protocolo de intervención integral, se ha recolectado una cantidad significativa de datos empíricos de la acción beneficiosa de Bacillus probióticos durante el cultivo de camarones. En este estudio nuestro objetivo fue medir los efectos de los probióticos Sanolife en un modelo de desafío a AHPND estandarizado en condiciones controladas de laboratorio.
Camarones de Ensayo
Camarones blancos del Pacífico (Litopenaeus vannamei) fueron criados y cuidados en el criadero de camarones y vivero de la Facultad de Acuacultura y Pesca, Universidad de Can Tho. Las poblaciones de camarón estaban bajo vigilancia para WSSV, YHV (IQ2000 YHV/GAV) y Vibrio de AHPND para mantener el estatus SPF.
Para este estudio, se utilizaron camarones de las etapas PL20-25, con un peso corporal promedio alrededor de 1 g, la edad y el tamaño más afectados por EMS / AHPND bajo condiciones de cultivo. Agua de mar natural se utilizó en todos los experimentos, esterilizada y diluida a 25 g/L, una salinidad típica de engorde de L. vannamei. Este estudio fue publicado originalmente en Aquaculture Asia Pacific 11(6):14-17.
Bacteria
Designamos la cepa bacteriana utilizada en este estudio como LTS14. Fue originalmente aislada de camarones diagnosticados con (histo)patología de AHPND en Vietnam en mayo de 2014 y almacenada a -80°C en TSB suplementado con NaCl al 1,5 por ciento y 25 por ciento de glicerol. La bacteria fue identificada como V. parahaemolyticus, por las colonias verdes en TCBS, pruebas bioquímicas convencionales API 20E y PCR con cebadores LTH. Además, el aislado fue positivo en PCR con cebadores AP3.
Antes del estudio, la virulencia de LTS14 se evaluó extensivamente por desafíos en vivo, y se comparó con otras cepas. La dosis de desafío se afinó con el fin de obtener una curva de mortalidad LD50-60 sub-aguda reproducible (Figura 1).
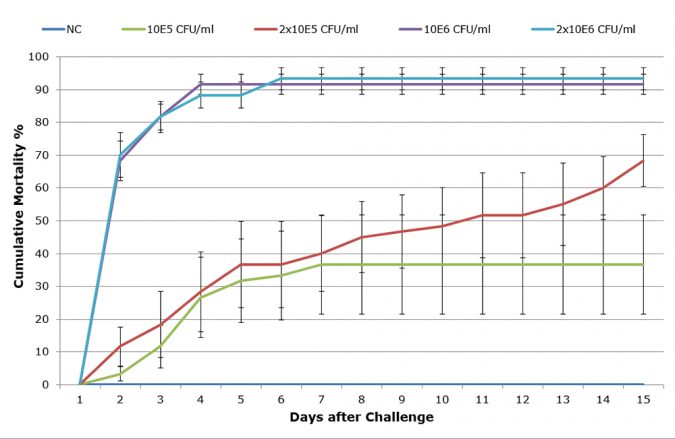
Desafío
Los cultivos bacterianos se criaron por 24 horas en TSB suplementado con 1,5 por ciento de NaCl a 28°C. Sobre la base de la curva estándar determinada para la cepa, la suspensión bacteriana se diluyó en agua de mar a una DO correspondiente a 108 células/ml. Los camarones se sumergieron durante 15 minutos en este cultivo bacteriano con aireación continua, y luego ambos solución bacteriana y camarones se transfirieron a los acuarios con agua de mar, reduciendo la concentración bacteriana a 105, 2 × 105, 106, 2 x 106 células/ml. No se recambio el agua de mar hasta dos días después del desafío, cuando se renovó el 20 por ciento de agua diariamente.
Diseño experimental
Los camarones del experimento fueron sembrados a una densidad de 30 individuos por acuario con 30 litros de agua y aireación continua, y los parámetros del agua se mantuvieron constantes a 29±1°C, pH 7,7 ± 2, NH3 <0,1 mg/L y OD a 4 mg/L con intercambio de agua diariamente.
Los siguientes cinco tratamientos por triplicado, se compararon:
| Descripción de tratamiento | Desafío con V. parahaemolyticus |
| Control negativo (NC) | – | – |
| Control positivo (PC) | – | + |
| Control antibiótico (AB) | doxiciclina 2g kg-1 alimento | + |
| Sanolife PRO-2 (PRO-2) | 10g kg-1 alimento | + |
| Sanolife PRO-W (PRO-W) | 5 mg l-1 | + |
Las aplicaciones de alimento fueron recubiertas con cada ración y se añadió la aplicación de Sanolife PRO-W al agua del acuario una vez al día. La dosis de Sanolife PRO-2 fue de 2 × 108 UFC de Bacillus por g de alimento, y la dosis de Sanolife PRO-W fue de 2,5 × 105 UFC de Bacillus por ml de agua. Aparte del NC, todos los camarones fueron desafiados con 2 × 105 UFC/ml de LTS14 y un seguimiento clínico se realizó durante 15 días después de la exposición.
La evaluación de los tratamientos se basó en la comparación estadística de: (1) la gravedad y el momento de aparición de los signos clínicos; (2) la mortalidad acumulada; y (3) la gravedad de la puntuación en la histopatología.
Gravedad de los signos clínicos AHPND
Se observaron signos clínicos tales como anorexia, letargo y coloración pálida del cuerpo y hepatopáncreas en 75 por ciento de los animales en el grupo de control positivo tan pronto como 24 horas después del desafío. Los camarones en los grupos AB y Sanolife PRO-W también mostraron síntomas de AHPND, pero con anorexia menos pronunciada, y en un grupo reducido de animales (50 por ciento). Menos de 20 por ciento de los camarones que recibieron Sanolife PRO-2 se registraron con síntomas de AHPND, y con un retraso significativo de 72 horas después del desafío. Fotos representativas de síntomas generales se muestran en la Figura 2.
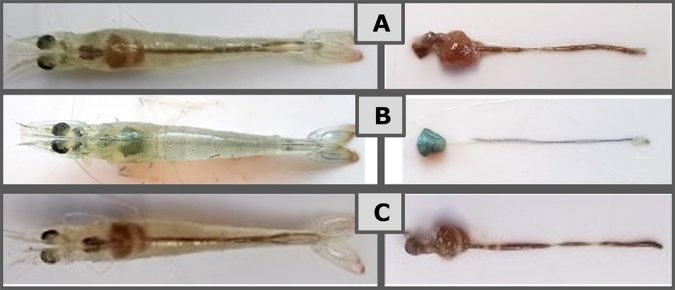
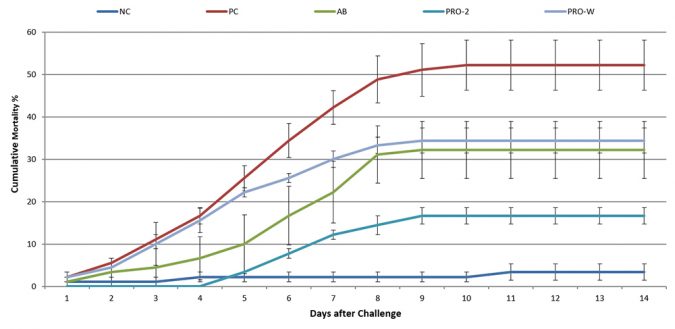
Mortalidad reducida
La mortalidad comenzó en el grupo PC 1 dpi (días después de la inoculación) y alcanzó una mortalidad acumulada de 52 ± 10 por ciento después de 10 días (Figura 3). En los grupos AB y Sanolife PRO-W, la mortalidad también se inició a 1 dpi y la mortalidad acumulada alcanzó 32 ± 12 por ciento y 34 ± 5 por ciento, respectivamente. Un retraso en la mortalidad de 4 días se observó para el grupo Sanolife 2-PRO, con una mortalidad acumulada parando en 17 ± 3 por ciento después de 9 días. El resultado de Sanolife PRO-2 fue estadística y significativamente más bajo que el PC, pero también más alto que el 3 ± 3 por ciento del NC.
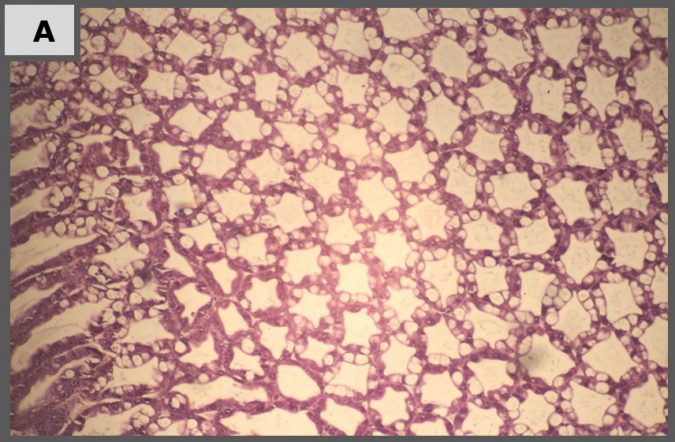
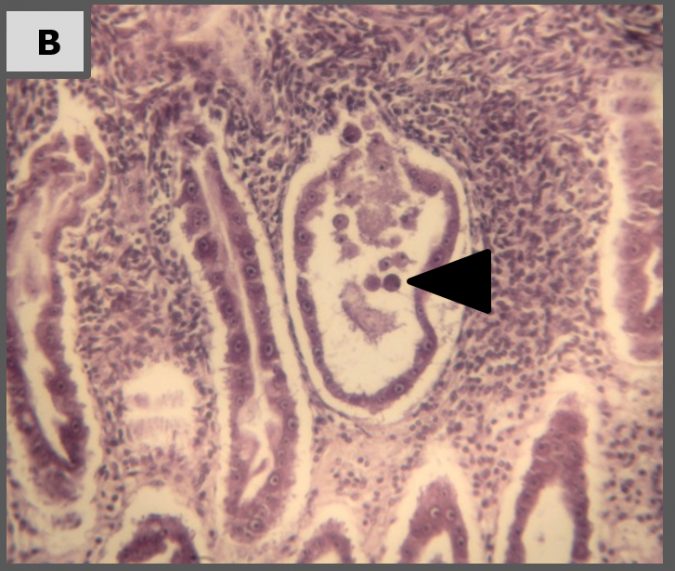
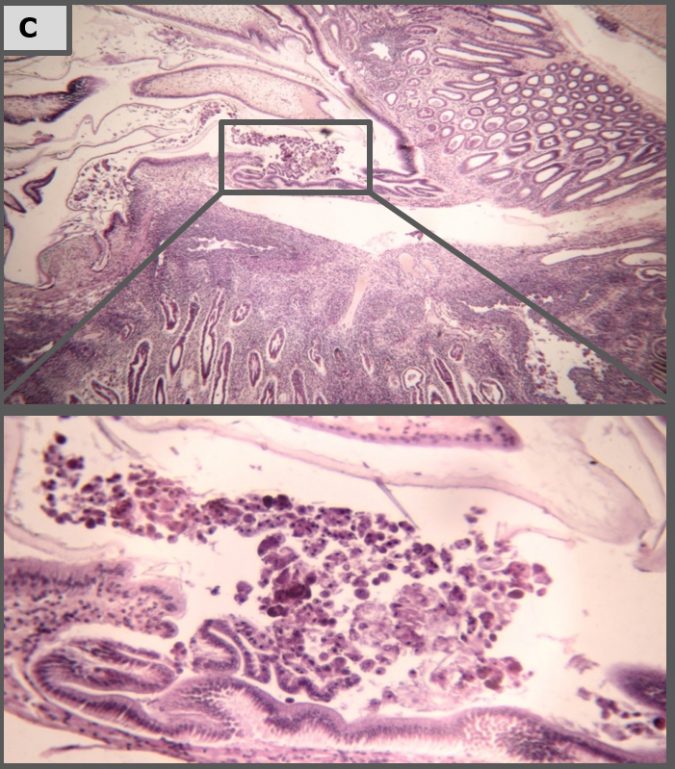
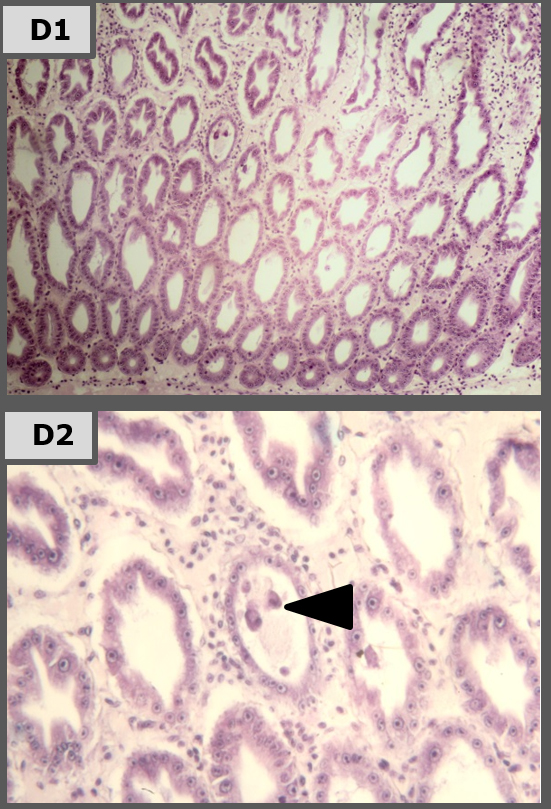
Histopatología
Imágenes representativas de análisis histopatológico de camarón en los diferentes tratamientos.
Perspectivas
El modelo de desafío a AHPND desarrollado y estandarizado para este estudio resultó en una curva de mortalidad del control positivo que alcanza su máximo después de varios días, y que no acaba con todos los camarones inoculado. Esto está más en línea con los brotes de AHPND en las granjas de camarón y también ofrece una mejor oportunidad para evaluar las posibles intervenciones terapéuticas que muchos modelos reportados de protección que usan imposiblemente altas concentraciones bacterianas y que resultan en mortalidad híper-aguda.
Los resultados de nuestro estudio de laboratorio muestran que tratamientos de Sanolife PRO-2 y de probióticos Sanolife PRO-W por sí mismos tienen efectos beneficiosos, como una mayor supervivencia y signos histológicos de regeneración de hepatopáncreas. Sin embargo, similar a los tratamientos con antibióticos, los tratamientos de probióticos no son suficientes para proteger completamente al camarón de la enfermedad. Para ello, es necesario un enfoque holístico, apoyando y corrigiendo el sistema de cría y el estado de salud del camarón en todos los niveles.
Authors
-

Dang Thi Hoang Oanh, Ph.D.
Head, Department of Aquatic Pathology
College of Aquaculture and Fisheries
Cantho University
3-2 Street, Ninhkieu District
Cantho City, VIETNAM
[110,118,46,117,100,101,46,117,116,99,64,104,110,97,111,104,116,100]
-

Mathias Corteel, Ph.D.
R&D Engineer
INVE Aquaculture,
Hoogveld 93, 9200 Dendermonde
BELGIUM[109,111,99,46,101,114,117,116,108,117,99,97,117,113,97,101,118,110,105,64,108,101,101,116,114,111,99,46,109]
-

Olivier Decamp, Ph.D.
Product Manager Health
INVE Aquaculture
Hoogveld 93, 9200 Dendermonde
BELGIUM
[109,111,99,46,101,114,117,116,108,117,99,97,117,113,97,101,118,110,105,64,112,109,97,99,101,100,46,111]
Tagged With
Related Posts

Health & Welfare
Genetic variation for resistance to WSS, AHPND in Pacific white shrimp
Selection for disease resistance has been used in breeding farm animals and can be a viable option to deal with white spot syndrome and acute hepatopancreatic necrosis disease in commercial shrimp culture. In trials, heritability for AHPND resistance was low, while that for WSS was moderate.

Health & Welfare
Limited decomposition enhances PCR detection of AHPND Vibrio in shrimp
A study confirmed the utility for improved polymerase chain reaction (PCR) detection of the Vibrio bacteria that cause acute hepatopancreatic necrosis disease (AHPND) in asymptomatic shrimp by permitting the shrimp to expire and decompose for several hours prior to preservation and PCR processing.

Health & Welfare
PCR methods characterize AHPND V.p isolates
In analyzing the plasmid sequence from the whole genome sequences of AHPND V. parahaemolyticus (V.p) isolates, researchers identified a clear geographical variation within the plasmid, and developed PCR methods to characterize AHPND V.p isolates as either Mexico-type or Southeast Asia-type.

Health & Welfare
Probiotics benefit Pacific white shrimp challenged with AHPND
A study was conducted to measure the effects of commercial probiotics on Pacific white shrimp in a standardized AHPND challenge model under controlled laboratory conditions. Results show that the probiotics treatments by themselves have beneficial effects, such as higher survival and histological signs of hepatopancreas regeneration.

